北大團隊升級RNA編輯技術:安全效率大幅提升,離臨床更近一步近年來,以CRISPR/Cas9為代表的基因組編輯技術在生物醫學等領域的研究和轉化嘗試如火如荼。但對大多數科學家來說,修改人類“生命密碼本”的工作仍在小心翼翼地進一步完善中。 RNA(核糖核酸)編輯即是近年來興起的一項新型基因編輯技術,並且國際藥企已經在該技術上進行布局。其中一項被命名為“LEAPER”的技術,系北京大學生命科學學院教授魏文勝團隊自主創新的RNA編輯技術。此前的2019年7月,魏文勝團隊在國際學術期刊《自然-生物技術》(Nature Biotechnology)上報道了LEAPER技術。北京時間2月11日凌晨,該研究團隊再次在《自然-生物技術》上報道了升級版LEAPER 2.0技術。
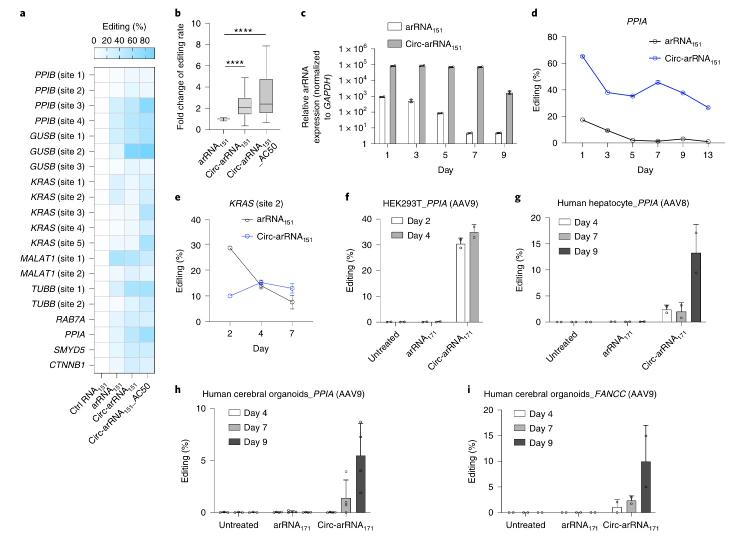
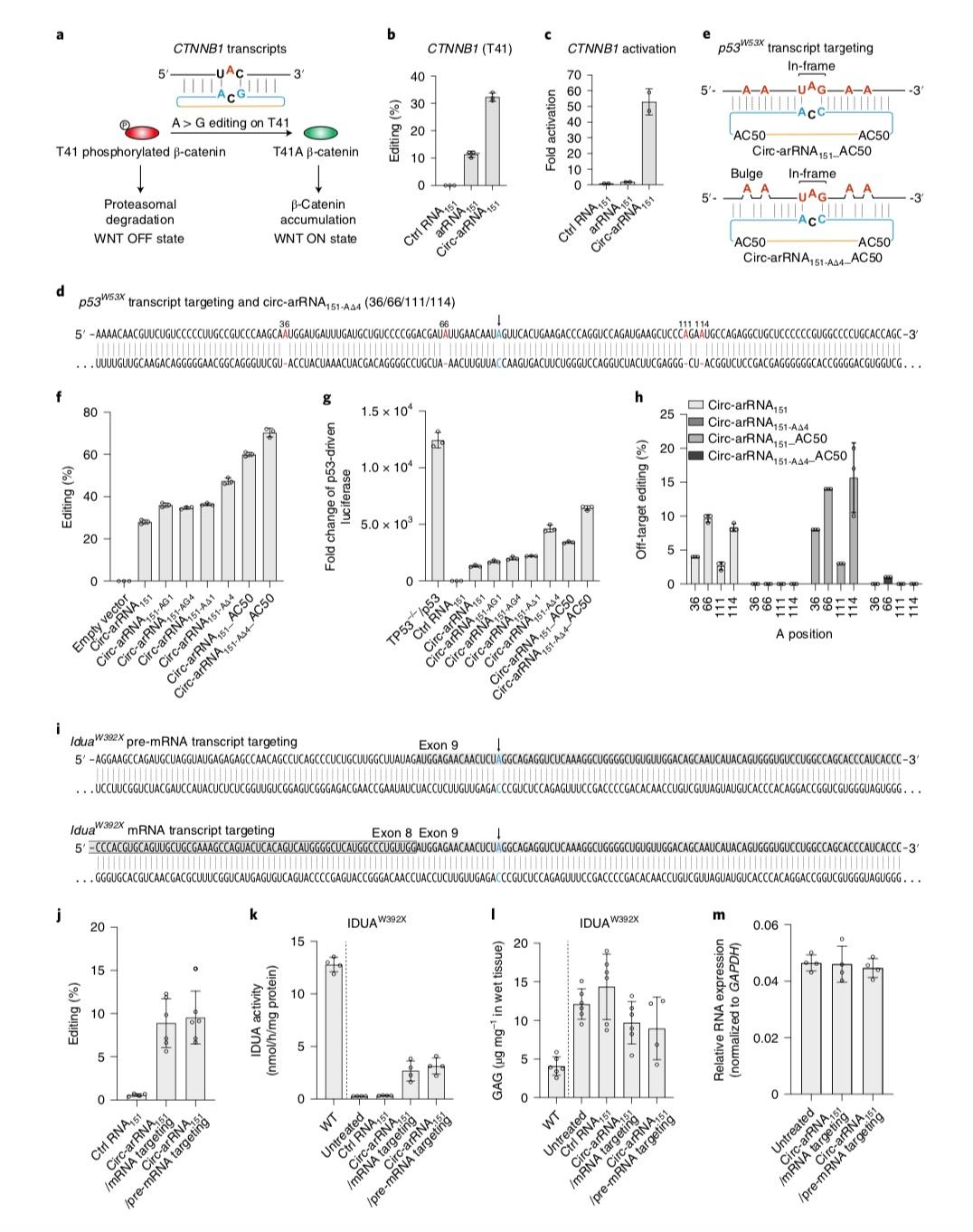
“與以CRISPR為基礎的DNA或者RNA編輯技術不同,LEAPER僅需要在細胞中表達特殊設計的RNA(ADAR-recruiting RNA, arRNA)即可招募細胞中內源脫氨酶ADAR,實現靶向目標RNA中腺甘A→肌甘I(鳥甘G)的編輯。”魏文勝在接受媒體採訪時表示,由於無需引入外源編輯酶或效應蛋白,避免了由此引起的基因組和轉錄組上的脫靶效應、遞送負擔以及相關的免疫原性等問題。 值得注意的是,LEAPER完全擺脫了對CRISPR系統的依賴,是具有自主知識產權的底層核心技術,具有重要的原始創新意義。 魏文勝同時提到一點,作為RNA精準編輯工具,“LEAPER不會引起基因組序列改變,在安全性方面具有優勢。”在這項最新的研究中,研究團隊對LEAPER的編輯效率和脫靶問題進行了進一步優化升級。 值得關注的是,《自然-生物技術》也同期刊發了加利福尼亞大學聖叠戈分校(UCSD)助理教授Prashant Mali團隊的一項研究,Mali等人同樣發現,運用可招募細胞內源ADAR脫氨酶的環形RNA能夠提高RNA編輯的效率。ADAR1脫氨酶是一類在人體內各組織中廣泛表達的腺甘脫氨酶,能夠催化目標RNA分子中腺甘A→肌甘I(鳥甘G)的轉換。 “雖然目前全世界大部分的RNA編輯技術的研究處於實驗室階段,但距離臨床應用已經越來越近了。” 魏文勝談到,在技術層面上,利用內源機制實現更安全的RNA編輯,“我們在國際上處於領先梯隊內,在這個研究領域具有競爭優勢。” 解決LEAPER兩大局限問題 以CRISPR/Cas9為代表的基因組編輯技術目前仍存在著一系列問題,其在臨床治療應用中也遭遇瓶頸。在魏文勝等人看來,問題的根源之一在於當前的基因編輯體系依賴於細菌或病毒來源的編輯酶或效應蛋白的表達,比如細菌中的Cas9核酸酶。 這一依賴會導致多重問題。例如蛋白分子量過大使得通過病毒載體進行裝載及人體內遞送十分困難、由蛋白過表達引起的DNA/RNA水平的脫靶效應、由外源蛋白表達引起的機體免疫反應及損傷、機體內的預存抗體使外源編輯酶或效應蛋白被抗體中和從而導致基因編輯失敗等。 魏文勝等人的解決思路是利用細胞中天然存在的機制。他們在此前的研究中首次發現,只需轉入一種特殊設計的ADAR-recruiting RNAs (arRNAs),就能夠通過招募細胞內源的ADAR1脫氨酶對靶向基因轉錄本上特定的腺甘產生高效精準的編輯,並不需要引入任何外源效應蛋白。這種新型RNA編輯技術即被命名為LEAPER (Leveraging Endogenous ADAR for Programmable Editing on RNA)。 研究團隊此前證明,LEAPER能對RNA分子上絕大多數的腺甘酸位點進行精準編輯。在人的原代細胞-包括肺成纖維細胞、支氣管上皮細胞及T細胞中,LEAPER的編輯效率最高可達80%。 “盡管LEAPER在科研和疾病治療中具有可觀的潛力,該技術還存在一定的局限。”魏文勝談到兩點,一是LEAPER利用的是內源編輯酶,其編輯效率會因此受限;另外,具有一定長度的arRNA可能使目標編輯位點鄰近的堿基發生脫靶編輯。 在這項最新的研究中,他們首先發現通過優化表達載體中的啟動子增強arRNA表達可以顯著提升LEAPER系統的編輯效率,“表明arRNA在細胞中的豐度對於編輯效率十分關鍵。” 另一個關鍵點在於,由於線性arRNA在細胞內容易被降解,團隊想到了利用環化方式。環形RNA由於沒有5’或3’末端,可以避免核酸外切酶的切割,在細胞內相比於線性RNA具有更好的穩定性和更長的半衰期。 “我們設計了工程化的環形arRNA(circ-arRNA)。”魏文勝表示,研究發現,circ-arRNA能夠維持較長時間的高水平表達。在多個內源轉錄本位點中,circ-arRNA平均編輯效率相比於線性版本提升了超過3倍,同時也可維持長達近半個月的有效編輯。 研究進一步發現,通過腺相關病毒(AAV)遞送,遺傳編碼的circ-arRNA可以在人的原代細胞和類器官中實現長時程的RNA編輯。另外,體外合成的circ-arRNA也可實現高效的靶向編輯,並且與遺傳編碼的circ-arRNA具有類似的特征。 魏文勝總結道,由於LEAPER 2.0 仍然使用細胞內源的編輯酶,無需外源過表達編輯酶,因此可以避免遞送困難和過表達外源編輯酶造成的全轉錄組範圍內的脫靶編輯。 另外重要的是,LEAPER 2.0通過特殊設計,消除了一種特別的鄰近堿基脫靶編輯(bystander off-target editing),在安全性、精準度上獲得大幅提升。
Circ-arRNAs能夠對內源轉錄本進行高效、持久的RNA編輯。 國內外均在進行RNA編輯技術轉化 和此前的版本類似,研究團隊在這項最新研究中也對LEAPER 2.0的應用潛能進行了評估。 他們的研究顯示,利用LEAPER 2.0技術,可以成功激活Wnt信號通路(一類在物種進化過程中高度保守的信號通路),修復TP53基因(一種抑癌基因)中的致病突變使其表達的p53蛋白恢復正常的轉錄調節功能。 研究團隊還初步在小鼠模型上進行了技術驗證。他們使用腺相關病毒將circ-arRNA遞送至Hurler綜合征疾病模型小鼠體內,可以成功修復IDUA轉錄本上的致病突變並恢復IDUA的正常催化功能。 Hurler綜合征是一類復雜的、進行性多系統受累的遺傳性溶酶體病,可影響全身器官和組織。患者由於艾杜糖醛酸酶a-L-Iduronidase (IDUA)的缺失,造成糖胺多糖(GAGs)在溶酶體的累積,引起多器官病變。該疾病屬於常染色體隱性遺傳病。
circ-arRNAs對細胞培養和Hurler綜合征小鼠蛋白質功能的激活和恢復。 魏文勝談到,“目前尚無治愈黏多糖貯積癥的方法,主要療法包括改善生活質量的對癥治療、酶替代治療和骨髓移植/造血幹細胞移植。現有療法則過於昂貴,而且患者和家屬需要花費大量時間在醫院,應用困難。” 他認為,針對這類疾病,RNA編輯具有優勢,“而我們新開發的LEAPER 2.0 與AAV遞送系統相結合可以實現長時程的有效編輯,這對治療Hurler綜合征等眾多的遺傳病是一個好的選擇。”除Hurler綜合征之外,魏文勝提到,LEAPER 2.0在眼部或者腦部遺傳疾病的治療上也已經觀察到了非常好的效果。 總體而言,魏文勝認為,LEAPER技術在臨床應用和疾病治療方面擁有其獨特的優勢和潛能。“LEAPER作為一項RNA編輯技術,其編輯是可逆、可調控的,而且編輯效果與劑量相關,原理上講更為安全。同時,LEAPER技術通過向細胞內遞送arRNA,招募內源ADAR蛋白完成編輯,遞送負擔輕,無需引入外源編輯酶,更加適應體內基因編輯治療。” 正如前述所說,在技術層面上,利用內源機制實現更安全的RNA編輯,國內科學家在國際上已處於領先梯隊,在這個研究領域具有極大的競爭優勢。而在產業轉化方面,國內外又處於怎樣的階段? 魏文勝表示,國際上已經有一些生物醫藥企業在開展相關技術轉化和開發工作,特別是去年,RNA編輯技術受到了極大關注。 例如,2021年8月,跨國制藥企業羅氏和Shape Therapeutics公司達成一項研發合作和許可協議,將利用其RNA編輯技術平台RNAfix,以及AAVid技術平台,開發治療阿爾茨海默病、帕金森病和罕見疾病的基因療法。隨後的2021年9月,禮來與ProQR Therapeutics達成一項全球性的許可和研究合作協議,兩家公司將利用ProQR專有的Axiomer RNA編輯技術平台,針對肝臟和神經系統遺傳疾病,推進新的藥物靶點的臨床開發和商業化,合作內容多達五個RNA編輯靶標。 至於國內,魏文勝提到,博雅輯因也正在開展LEAPER技術的轉化工作。作為國內基因編輯領域的先鋒,博雅輯因成立於2015年,總部位於北京,辦公地點分布於廣州、上海和美國劍橋,魏文勝系創始人。 博雅輯因首席執行官魏東此前接受媒體採訪時表示,對基因編輯這種特別創新的技術來說,“它的首要任務就是要在不同的疾病上能夠真正看見技術轉化的產品,是不是有足夠多的受益,而且安全可控。”特別嚴重且尚無有效療法的疾病,例如遺傳病和癌癥是目前創新療法的主要“驗證區”。 魏東提到,公司目前整個管線的布局包括體外療法和體內療法。其中,體內療法即基於LEAPER技術,正在針對眼科、神經系統等疾病進行研發。2020年,公司也曾在2020年的美國ASGCT年會上報告通過對IDUA信使RNA序列中第402密碼子進行精準的、針對特定序列的腺甘A→肌甘I轉換,生成野生型IDUA基因的信使RNA和蛋白質,治療黏多糖貯積癥I型最嚴重亞型Hurler綜合征中的W402X突變患者的早期研究數據。 魏文勝在此次採訪中也提到,針對LEAPER 2.0技術,博雅輯因正在開展相關轉化工作。公司通過AAV遞送開展了臨床前研究,並在多個研究模型中取得了很好的數據,實現了LEAPER 2.0轉化為體內編輯療法的概念驗證。 去年11月,博雅輯因還與北京協和醫院睢瑞芳教授團隊達成了研究合作,基於中國遺傳性視網膜變性(IRD)人群的基因變異特征,探索推進體內基因編輯療法;同月,該公司還也與威斯康星大學麥迪遜分校的David Gamm實驗室達成研究合作,評估公司基於LEAPER技術的RNA堿基編輯候選療法針對特定遺傳疾病的藥理特性。 【編輯:馬華】
|